Auteurs
Odile Carisse, Ph.D., phytopathologie, et Tristan Jobin, M.Sc.
Agriculture et Agroalimentaire Canada
Centre de recherche et de développement en horticulture
Avec la collaboration de :
- Wendy McFadden-Smith, Ph.D.
McSmith Agricultural Research Services - Catherine Meloche, M.Sc.
Agriculture et Agroalimentaire Canada - Jacques Lasnier
Co-Lab Recherche and Développement
Introduction
Dans l'est du Canada, la tavelure est la principale maladie du pommier. La tavelure est présente chaque année et peut entraîner des pertes importantes directes puisque les fruits infectés ne sont pas vendables, et des pertes indirectes car les arbres défoliés s'affaiblissent et survivent moins bien à l'hiver.
La lutte contre la tavelure du pommier représente des coûts importants tant au niveau de l'utilisation des fongicides que du temps alloué à la gestion de la maladie. Dans un contexte où il y a de plus en plus de pression sur l'industrie pomicole pour réduire l'usage des pesticides, diminuer les coûts de production et maintenir la qualité des pommes, nous croyons qu'il est important de simplifier et d'optimiser la gestion de cette maladie.
Le développement de la résistance aux fongicides pourrait venir compliquer la gestion de la tavelure. La lutte contre la tavelure est basée sur l'utilisation de fongicides. Or, certains fongicides curatifs pourraient perdre leur efficacité suite à l'adaptation du champignon. La perte de ces fongicides aurait des conséquences importantes d'autant plus que les fongicides dits de protection ont généralement plus d'impacts négatifs sur l'environnement.
Les objectifs de ce guide sont :
- (1) de résumer les connaissances disponibles;
- (2) de présenter de nouveaux outils de gestion de la tavelure; et
- (3) de simplifier l'application des outils de lutte.
Quelques éléments de la gestion de la tavelure
- Gestion de l'inoculum primaire
- Prévision des risques : infections primaires
- Sensibilité et croissance de l'hôte
- Résistance aux fongicides
- Système de production
- Prévision des risques : inoculum primaire
- Application fongicide
- Prophylaxie
Biologie : symptômes
La tavelure du pommier est causée par un champignon dont le nom scientifique est Venturia inaequalis. Cette maladie affecte également le pommetier. Son développement est favorisé par des conditions printanières fraîches, humides et pluvieuses. Si la tavelure n'est pas contrôlée, elle causera des taches sur les fruits qui réduiront la quantité et la qualité de la récolte.
Symptômes
Les feuilles et les fruits sont plus sensibles à la tavelure lorsqu'ils sont jeunes et en période de croissance. En conséquence, les risques de tavelure sont plus grands au printemps durant les périodes de croissance rapide du feuillage et des fruits. Les feuilles et les fruits matures sont plus résistants.
Feuilles
Les taches sont petites, pâles et irrégulières. En vieillissant les taches prennent une forme circulaire mieux définie, une teinte olivâtre et un aspect velouté. À un stade avancé, les taches deviennent noires et légèrement soulevées. Les feuilles très infectées peuvent se dessécher, se déformer et tomber.
Fleurs
Les taches ressemblent à celles sur les feuilles, par contre une seule tache sur le pédoncule ou les sépales peut les faire dessécher et tomber.
Fruits
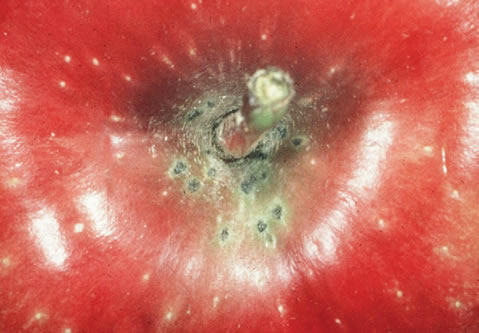
Une infection tôt en saison peut causer la chute ou la déformation des jeunes fruits en croissance. Les taches sur les fruits sont semblables à celles sur le feuillage mais en vieillissant, elles évoluent en crevasses. Si les fruits sont infectés à la fin de l'été ou au début de l'automne, les taches ne seront visibles que durant l'entreposage. Ces taches appelées en anglais 'pin-point scab' sont noires, circulaires et assez petites (0,1 - 4 mm de diamètre).
La tavelure ne tue généralement pas les arbres mais elle peut causer une chute des feuilles ce qui affaiblira l'arbre et nuira à sa survie à l'hiver.
Jeune lésion en début de développement

Lésions secondaires


Lésions sur fruit


Lésions d'entrepôt
Biologie : cycle vital de l'agent pathogène
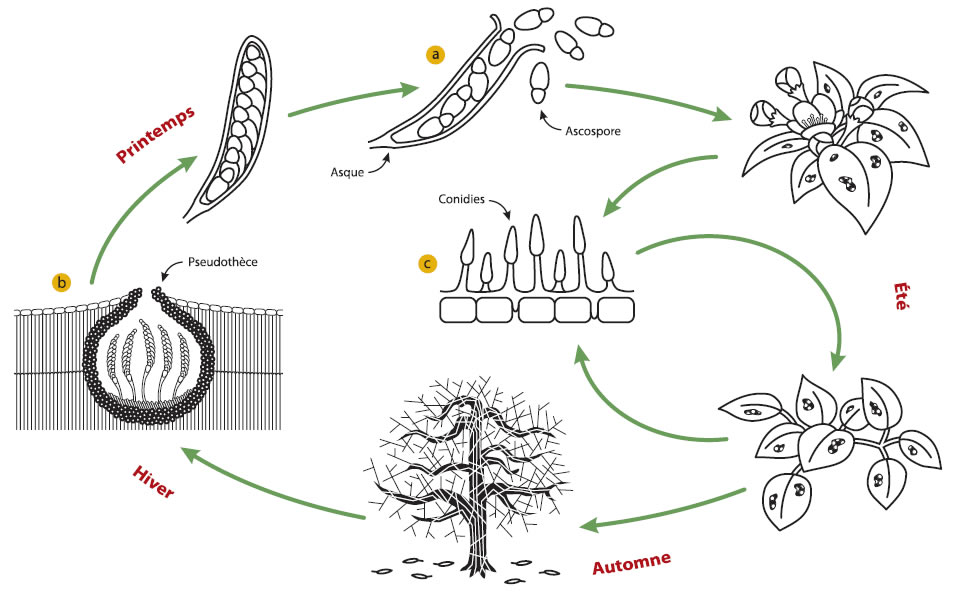
Venturia inaequalis est un champignon microscopique de la famille des ascomycètes, c'est-à-dire qui produit des structures de reproduction en forme de sac appelées asques (a).
À l'automne, après la chute des feuilles, le champignon se reproduit sexuellement et pénètre dans les feuilles pour produire une structure de survie appelée pseudothèce qui le protégera contre les rigueurs de l'hiver (b).
Au printemps, lorsque la température augmente, le champignon produit des spores appelées ascospores dans les sacs à l'intérieur des pseudothèces. Les ascospores matures sont éjectées dans l'air durant une pluie ou une rosée importante et dispersées par le vent et la pluie.
Lorsque des ascospores se déposent sur une jeune feuille ou un jeune fruit et que les conditions leur sont favorables, elles germent rapidement et un mycélium se développe et forme des taches diffuses.
Cette période d'infection primaire ou infection par les ascospores dure de six à huit semaines, à partir du stade plante verte jusqu'au milieu ou la fin du mois de juin, soit environ 2 semaines après la nouaison.
Plus tard, les taches prennent un aspect duveteux indiquant que le mycélium mature produit des conidies aussi appelées spores d'été (c). Les conidies sont dispersées par la pluie et le vent. Lorsqu'elles se déposent sur les feuilles ou les fruits, elles causent de nouvelles taches, qui produiront de nouvelles spores et ainsi de suite. Ces infections secondaires causées par les conidies, peuvent se poursuivre tout l'été si les conditions sont favorables.
Mesures préventives
Prévenir pour mieux guérir :
Variétés
Pour les nouvelles plantations, choisir si possible des variétés peu ou modérément sensibles (voir tableau).
Taille
Effectuer une bonne taille afin de favoriser l'aération ou le séchage du feuillage plus rapide et une bonne couverture des fongicides.
Fertilisation
Il faut maintenir un bon programme de fertilisation, mais éviter les excès d'engrais azotés qui encouragent la croissance rapide de pousses tendres (gourmands) plus vulnérables aux infections. L'irrigation en période de sécheresse aide à maintenir la vigueur des arbres.
Réduction de l'inoculum
Puisque le champignon hiverne dans les feuilles mortes, leur destruction par brûlage, fauchage ou labourage du sol contribue à réduire l'inoculum primaire (ascospores). Une application d'urée ou de champignons antagonistes permet également de réduire la survie du champignon à l'hiver et, par conséquent, les risques de tavelure le printemps suivant.
Sensibilité des variétés de pommiers
- Très sensibles
- 'McIntosh';
- 'Vista Bella'
- Sensibles
- 'Cortland';
- 'Red Cortland' (RedCort);
- 'JerseyMac';
- 'Jonamac';
- 'Lobo'
- Modérément sensibles
- 'Early Geneva';
- 'Empire';
- 'Golden Delicious';
- 'Jonagold';
- 'Lodi';
- 'Mutsu';
- 'Northern Spy';
- 'Spartan';
- 'Royal Gala'
- Peu sensibles
- 'Golden Russet';
- 'Idared';
- 'Red Delicious';
- 'Sunrise';
- 'Paulared'
- Résistantes
- 'Belmac',
- 'Enterprise',
- 'Freedom',
- 'Florina' (Querina),
- 'Jonafree',
- 'Liberty',
- 'Macfree',
- 'Nova Easygro',
- 'Novamac',
- 'Primevere',
- 'Pristine',
- 'Redfree',
- 'Richelieu',
- 'Rouville',
- 'Supermac'
Automne
Réduction de l'inoculum primaire : traitements d'automne
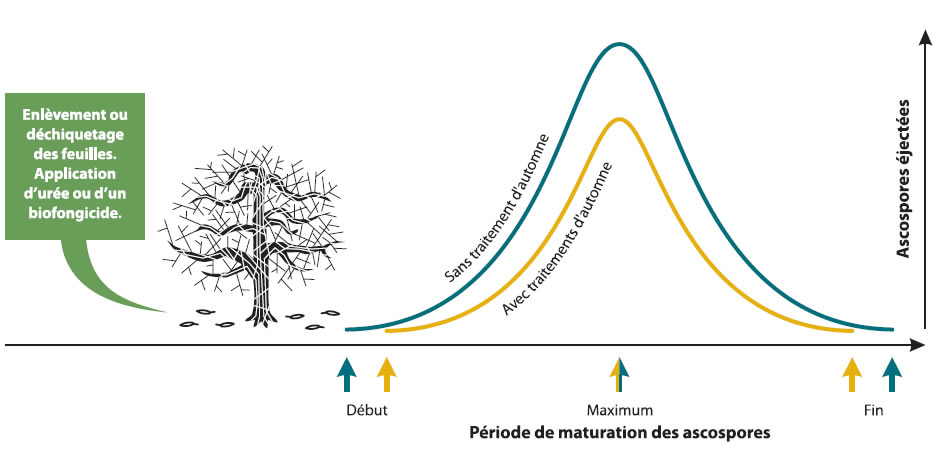
Les traitements d'automne comprennent le déchiquetage, le paillage, le brûlage ou l'enlèvement des feuilles, et l'application d'urée ou d'agents de lutte biologique.
Le déchiquetage/paillage implique de pousser les feuilles vers le milieu des allées puis de passer la faucheuse sur les feuilles. Ce traitement ainsi que l'application d'urée ou d'agents de lutte biologique se fait lorsque la majorité des feuilles sont tombées et, possiblement, tôt au printemps avant le débourrement. Ces traitements d'automne ne peuvent pas être faits chaque année puisque les feuilles doivent être tombées avant les premières neiges.
Les traitements d'automne servent à réduire la quantité d'ascospores qui seront produites dans le verger le printemps suivant. Des recherches ont démontré que les traitements d'automne peuvent réduire la quantité d'inoculum jusqu'à 95 % dans les meilleures conditions.
Dans les vergers plantés avec des cultivars sensibles et les vergers très tavelés, les traitements d'automne ne permettent pas de réduire le nombre d'applications de fongicide requises au printemps. Par contre, si des traitements d'automne sont faits, les risques de tavelure sur feuilles et sur fruits seront beaucoup plus faibles.
Dans les vergers peu tavelés et pour les cultivars peu sensibles, les traitements d'automne permettent de réduire le nombre d'applications de fongicide requises au printemps.
Peu importe les traitements d'automne utilisés, le patron de maturation des ascospores ne changera pas mais la quantité d'ascospores sera plus basse (voir figure). Les modèles de prévision de la maturité des ascospores peuvent donc être utilisés.
Estimer la quantité d'ascospores présentes dans le verger
Il existe une méthode dite 'PAD', de l'anglais 'potential ascospore dose', basée sur une évaluation de la tavelure sur feuille à l'automne avant la chute des feuilles. La mesure du PAD permet de déterminer si, globalement, la quantité d'ascospores dans le verger sera faible ou élevée le printemps suivant.
Échantillonnage séquentiel pour la tavelure à l'automne
Quand : après la récolte et avant la chute des feuilles
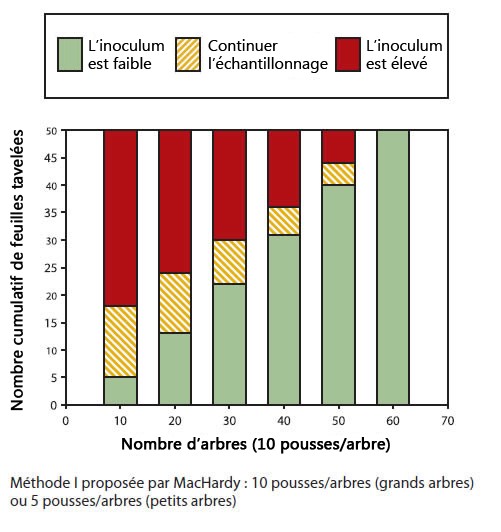
Pour la méthode I de MacHardy : pour les grands arbres, compter le nombre de feuilles tavelées sur 10 arbres, 10 pousses/arbre. Pour les petits arbres, compter le nombre de feuilles tavelées sur 20 arbres, 5 pousses/arbre. Si vous utilisez la méthode II simplifiée, échantillonner 100 pousses.
- Choisir au hasard les pousses dans le verger, choisir des pousses de bouquet et végétatives, dans toutes les parties de l'arbre (haut, bas, intérieur et extérieur) incluant les gourmands.
- Si le nombre de feuilles tavelées est sous le seuil (zone en vert), une protection serrée ne sera pas nécessaire le printemps suivant. Certaines infections à faible risque (durée de mouillure courte, peu d'ascospores et de nouvelles feuilles) pourront être laissées sans contrôle, particulièrement au tout début et à la fin de la période des infections primaires.
- Si le nombre de feuilles tavelées est au-dessus du seuil (zone rouge), une protection sans faille sera nécessaire le printemps suivant. Toutes les infections primaires devront être traitées.
- Si le nombre de feuilles tavelées est dans la zone intermédiaire (zone orange), il faut continuer l'échantillonnage sur une autre série de pousses avant de prendre une décision. Continuer l'échantillonnage sur 10 ou 20 arbres si on a utilisé la méthode proposée par MacHardy ou sur 10 nouvelles pousses si on a utilisé la méthode simplifiée.
Description de l'image ci-dessus
Méthode I proposée par MacHardy : 10 pousses/arbre (grands arbres) ou 5 pousses/arbre (petits arbres). Le tableau suivant présente le nombre cumulatif de feuilles tavelées par le nombre d'arbres (10 pousses/arbre) et identifie la zone correspondante.
| Nombre d'arbres (10 pousses/arbre) | L'inoculum est failble (zone verte) | Continuer l'échantillonnage (zone orange) | L'inoculum est élevé (zone rouge) |
|---|---|---|---|
| 10 | 0-5 | 6-18 | 19-50 |
| 20 | 0-13 | 14-23 | 24-50 |
| 30 | 0-22 | 23-30 | 31-50 |
| 40 | 0-31 | 32-36 | 37-50 |
| 50 | 0-40 | 41-44 | 45-50 |
| 60 | 0-50 |
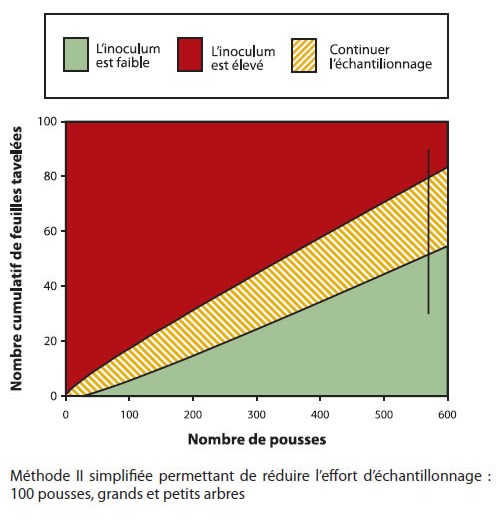
Description de l'image ci-dessus
Méthode II simplifiée permettant de réduire l'effort d'échantillonnage : 100 pousses, grands et petits arbres. Le tableau suivant présente le nombre cumulatif de feuilles tavelées par le nombre de pousses et identifie la zone correspondante.
| Nombre de pousses | L'inoculum est faible (zone verte) | Continuer l'échantillonnage (zone orange) | L'inoculum est élevé (zone rouge) |
|---|---|---|---|
| 100 | 0-6 | 7-18 | 18-100 |
| 200 | 0-14 | 15-32 | 33-100 |
| 300 | 0-22 | 23-43 | 44-100 |
| 400 | 0-35 | 36-58 | 59-100 |
| 500 | 0-43 | 44-70 | 71-100 |
| 600 | 0-55 | 56-81 | 82-100 |
Printemps
Infections primaires : estimer les risques d'infection
La tavelure du pommier est une maladie qui se développe en deux phases : la phase des infections primaires causées par les ascospores et celle des infections secondaires causées par les conidies. Les jeunes feuilles sont sensibles dès leur apparition jusqu'à l'âge de 8 jours environ; en vieillissant, elles perdent graduellement leur sensibilité.
Infections primaires
Les infections primaires sont causées par une quantité de spores (ascospores) qui est déterminée par le niveau de tavelure à l'automne précédent et les conditions hivernales.
Donc, plus le verger était tavelé l'automne précédent, plus les risques d'infections primaires sont élevés le printemps suivant.
Ainsi, toute pratique ou traitement visant à réduire l'inoculum hivernant réduira aussi les risques d'infections au printemps.
Puisque la quantité d'ascospores est limitée et que de nouvelles ascospores ne seront pas produites au printemps, il est très important de bien contrôler les infections primaires afin d'éviter les infections secondaires.
Comment identifier la gravité des infections primaires
La gravité d'une infection, ou le nombre de lésions par feuille, dépend de la quantité d'ascospores, de la sensibilité du feuillage ou du fruit et des conditions climatiques, essentiellement la température et la durée de mouillure du feuillage. Les risques d'infection sont calculés à partir de la durée de mouillure et de la température (voir tableau ci-dessous).
On commence par compter les heures de mouillure à partir du début d'une pluie où le feuillage est mouillé et on arrête lorsque le feuillage est sec.
Lorsque 2 périodes de mouillure sont séparées par une période sans mouillure, il y a 3 scénarios possibles :
- La période sans mouillure est de moins de 24 heures et l'humidité relative est plus de 85 % : on additionne toutes les heures.
- La période sans mouillure est de moins de 24 heures et l'humidité relative est moins de 85 % : on additionne les heures de mouillure seulement.
- La période sans mouillure est plus de 24 heures : on considère les 2 périodes de mouillure comme des périodes d'infection différentes.
Compte tenu que les éjections d'ascospores sont faibles durant la nuit, lorsque la période de mouillure commence la nuit, on commence généralement à compter les heures de mouillure au lever du soleil sauf en période d'éjection abondante ou dans un verger très tavelé l'année précédente.
Température minimum pour une infection à différentes durées de mouillure
| Durée de mouillure (h) | Température (°C) |
|---|---|
| 41 | 1 |
| 35 | 2 |
| 30 | 3 |
| 28 | 4 |
| 21 | 5 |
| 18 | 6 |
| 15 | 7 |
| 13 | 8 |
| 12 | 9 |
| 11 | 10 |
| 9 | 11 |
| 8 | 12-13 |
| 7 | 14-15 |
| 6 | 16-24 |
| 8 | 25 |
| Exemple - Si la mouillure est d'une durée de 15 h [link abbreviation “heures”] et que la température moyenne n'est pas inférieure à 7°C durant cette période, il n'y a pas de risques d'infection. | |
Période d'éjection des ascospores
Typiquement, les premières ascospores matures et prêtes à causer une infection sont observées au débourrement. La maturation des ascospores se poursuit sur une période de 6 à 8 semaines. Généralement, la plus grande quantité d'ascospores matures est disponible du stade pré-bouton rose à la nouaison.
Bien que la quantité d'ascospores soit définie par le niveau de tavelure l'automne précédent, la vitesse de maturation des ascospores au printemps est déterminée par la température. Plusieurs modèles ont donc été développés pour prédire la proportion d'ascospores qui seront éjectées en fonction de l'accumulation des degrés-jours.
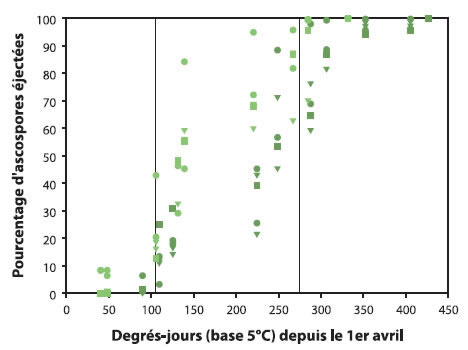
Description de l'image ci-dessus
Les données suivantes sont approximatives.
| Degrés-jours (base 5°C) depuis le 1er avril | Pourcentage d'ascospores éjectées |
|---|---|
| 40.5 | 0 |
| 8.3333 | |
| 0 | |
| 0 | |
| 0,0157 | |
| 48.15 | 6,4092 |
| 8,3652 | |
| 0,8938 | |
| 0,8938 | |
| 0,0157 | |
| 105.7 | 42,8782 |
| 20,4349 | |
| 18,7514 | |
| 16,2921 | |
| 12,6003 | |
| 131.5 | 46,3376 |
| 29,1172 | |
| 32,6736 | |
| 46,9774 | |
| 48,5134 | |
| 139,1 | 84,172 |
| 45,2729 | |
| 56,0935 | |
| 59,3454 | |
| 55,1451 | |
| 220,45 | 94,8958 |
| 72,1604 | |
| 68,9227 | |
| 60,0264 | |
| 68,0322 | |
| 267,1 | 95,7303 |
| 81,786 | |
| 87,5677 | |
| 62,8609 | |
| 86,8604 | |
| 284,7 | 99,6246 |
| 99,2573 | |
| 99,7585 | |
| 70,222 | |
| 95,6937 | |
| 331,85 | 100 |
| 100 | |
| 100 | |
| 100 | |
| 100 |
Calcul des degrés-jours
À partir du 1er avril, les degrés-jours (DJ) se calculent en utilisant les données de températures maximum (Tmax) et minimum (Tmin) du jour pour les appliquer à la formule suivante où la température de base (Tbase) est 5 °C :
DJ = [(Tmax + Tmin) ÷ 2] − Tbase
Peu importe la quantité de feuilles tavelées ou d'ascospores présentes dans le verger, les ascospores mûrissent en 3 phases :
- Phase 1 : du débourrement au stade pré-bouton rose; les ascospores mûrissent lentement parce que la température est généralement fraîche.
- Phase 2 : du stade pré-bouton rose jusqu'à la chute des pétales et après; le mûrissement des ascospores s'accélère avec l'augmentation des températures.
- Phase 3 : les dernières ascospores mûrissent jusqu'à l'épuisement du stock d'ascospores soit approximativement 2 semaines après la nouaison sur 'McIntosh'.
En pratique, il y a tellement de variation dans la proportion d'ascospores matures entre les cultivars et entre les feuilles que les degrés-jours ne devraient être utilisés que pour déterminer la période à risque qui va de 50 à environ 400 DJ en base 5°C accumulés depuis le 1er avril.
Durant cette période, les ascospores sont éjectées durant les pluies ou les rosées abondantes. Les ascospores sont éjectées majoritairement le jour bien que des ascospores puissent être éjectées la nuit dans des vergers très tavelés l'automne précédent.
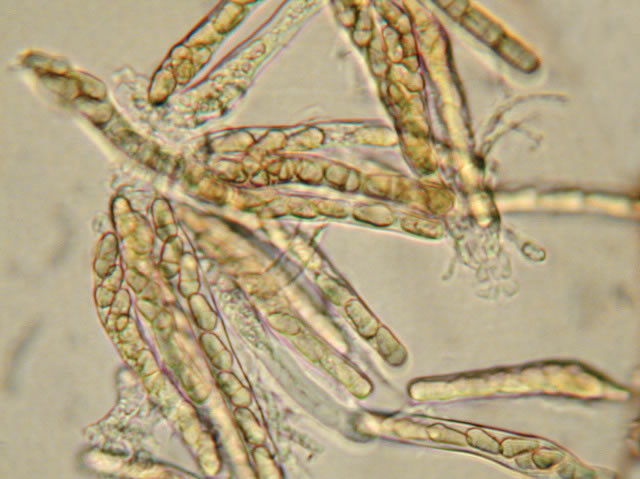
Ascospores du Venturia inaequalis.
Croissance foliaire : estimer l'émergence des feuilles
Comment déterminer la quantité de feuillage
L'émergence des feuilles au printemps est déterminée par la température. Il est donc possible d'estimer l'émergence des feuilles sur les pousses de bouquet et végétatives à partir des degrés-jours. Les deux tableaux ci-dessous peuvent être utilisés pour estimer le nombre de feuilles par pousse de bouquet et par pousse végétative.
Les degrés-jours sont calculés en base 5°C et sont accumulés depuis le 1er avril :
Degrés-jours = [(Tmax + Tmin) ÷ 2)] − 5°C
| Degrés-jours | Nbre feuilles |
|---|---|
| 96 | 1 |
| 110 | 2 |
| 120 | 3 |
| 130 | 4 |
| 140 | 5 |
| 154 | 6 |
| 178 | 7 |
|
Note : la précision dans l'estimation du nombre de feuilles par pousse est de ±2 degrés-jours. |
|
| Degrés-jours | Nbre feuilles |
|---|---|
| 120 | 1 |
| 133 | 2 |
| 148 | 3 |
| 166 | 4 |
| 184 | 5 |
| 206 | 6 |
| 230 | 7 |
| 254 | 8 |
| 282 | 9 |
| 314 | 10 |
| 348 | 11 |
| 386 | 12 |
| 430 | 13 |
| 478 | 14 |
| 534 | 15 |
| 598 | 16 |
| 674 | 17 |
| 766 | 18 |
| 882 | 19 |
| 1033 | 20 |
|
Note : la précision dans l'estimation du nombre de feuilles par pousse est de ±2 degrés-jours. |
|
Feuillet récapitulatif
Raisonner la lutte : infections primaires
Il y a plusieurs facteurs à considérer au moment de décider si une application de fongicide est nécessaire ou non. Parmi ces facteurs se retrouvent :
- la sensibilité du cultivar;
- le potentiel d'inoculum dans le verger;
- les conditions météorologiques lors de la maturation des ascospores et des périodes d'infection;
- la croissance du pommier ou l'émergence des feuilles;
- l'efficacité des fongicides.
Automne précédent
méthode I ou méthode II simplifiée (page 6). Si le potentiel d'inoculum est élevé, il faudra appliquer une protection sans faille tout au long de la période des infections primaires.
Printemps : risques d'infection associés au pathogène
- Mesurer ou obtenir les données météo sur la pluie (durée en heures) et la température moyenne durant la pluie (°C). Si possible, obtenir les prévisions météo pour les 3 prochains jours.
- Calculer les DJ depuis le 1er avril :
DJ = [(Tmax + Tmin) ÷ 2] − 5 °C - Déterminer si une infection est prévue à partir des prévisions météo (voir tableau Température minimum pour une infection à différentes durées de mouillure).
- Optionnel : déterminer si l'infection est légère, modérée ou grave (tableau ci-dessous).
- Déterminer s'il y aura une éjection d'ascospores lors de la prochaine pluie en se basant sur les DJ accumulés (voir figure : Pourcentage d'ascospores éjectées par degrés-jour (base 5°C) depuis le 1er avril). Si plusieurs DJ se sont accumulés depuis la dernière pluie (plusieurs journées chaudes), les risques d'éjection et la quantité d'ascospores seront plus importants et, par conséquent, les risques d'infection seront plus grands.
| Température (°C) | Sévérité de l'infection | ||
|---|---|---|---|
| Légère (h) | Modérée (h) | Grave (hrs.) | |
| 25,5 | 10 | 14 | 23 |
| 25 | 8 | 11 | 18 |
| 24-25 | 6.5 | 9 | 16 |
| 16-24 | 6 | 9 | 16 |
| 15,5 | 6.5 | 10 | 17 |
| 14-15 | 7 | 11 | 19 |
| 12-13 | 8 | 12 | 20 |
| 11 | 9 | 14 | 22 |
| 10 | 11 | 16 | 26 |
| 9 | 12 | 17 | 27 |
| 8 | 13 | 21 | 34 |
| 7 | 15 | 23 | 37 |
| 6 | 18 | 27 | 44 |
| 5 | 21 | 34 | 50 |
| 4 | 28 | 42 | 57 |
| 3 | 30 | 52 | 65 |
| 2 | 35 | 69 | 93 |
| 1 | 41 | 69 | 93 |
Printemps : risques d'infection associés à la croissance du pommier
- Déterminer le nombre de nouvelles feuilles depuis la dernière application de fongicide selon les degrés-jours accumulés (voir les tableaux Pousses de bouquets et Pousses végétatives).
- Appliquer un fongicide selon le risque d'infection, d'éjection d'ascospores et du nombre de feuilles non-protégées.
L'efficacité du traitement fongicide dépend de :
- La croissance foliaire : les nouvelles feuilles ne sont pas protégées et la croissance des feuilles cause un effet de 'dilution' du fongicide.
- L'intensité de la pluie : les fongicides de protection sont lessivés par 25 mm et plus de pluie.
- Le temps écoulé depuis le dernier traitement : l'efficacité du fongicide de protection diminue graduellement pour atteindre le niveau 'zéro efficacité' après environ 7 à 10 jours.
Voir l'exemple de raisonnement ci-dessous :
| 29 Avril 80 DJ | 4 Mai 102 DJ | 9 Mai 129 DJ | 14 Mai 162 DJ | 19 Mai 215 DJ | 24 Mai 259 DJ | 29 Mai 307 DJ | 3 Juin 342 DJ | |
|---|---|---|---|---|---|---|---|---|
| Bouquets | 0 | 0 | 4 | 6 | 7 | 7 | 7 | 7 |
| Végétatifs | 0 | 0 | 1 | 3 | 6 | 8 | 10 | 11 |
| Nouvelles feuilles | 0 | 0 | 5 | 4 | 4 | 2 | 2 | 1 |
| Pluie (h) | 16 | 0 | 0 | 18 | 13 | 12 | 0 | 8 |
| Température (°C) | 8 | 14 | 18 | 14 | 9 | 14 | 15 | 19 |
| Infection | Yes | No | No | Yes | Yes | Yes | No | Yes |
| Éjection ascospores | Yes | No | No | Yes | Yes | Yes | No | Yes |
| Risques* | P | A | A | H | H | P | A | H |
| Risques: A = absents, P = présents; É = élevés | ||||||||
Été
Infections secondaires : estimer les risques
Les infections secondaires ou tavelure d'été sont causées par des spores (conidies) qui augmenteront en nombre à chaque infection primaire mal contrôlée et à chaque nouvelle infection secondaire. Il est donc très important d'éviter d'avoir de la tavelure secondaire dans le verger sinon la situation peut rapidement devenir incontrôlable. Comme pour les infections primaires, la gravité des infections secondaires dépend de la température et de la durée de mouillure du feuillage.
Le tableau ci-dessous indique la durée de mouillure nécessaire pour causer une infection à différentes températures.
En conditions humides ou pluvieuses et modérément chaudes, les lésions apparaîtront environ une semaine après l'infection. Sous ces conditions, les lésions produiront une grande quantité de spores et la tavelure d'été se développera rapidement. Si les conditions estivales sont sèches et chaudes, les lésions produiront peu ou pas de nouvelles spores. Dans ces conditions, la tavelure d'été se développera lentement ou pas du tout.
Si l'application de fongicides est nécessaire durant l'été suite à un mauvais contrôle des infections primaires, cela augmentera significativement les coûts de production et les risques pour l'environnement.
Il est difficile de déterminer si les traitements d'été sont nécessaires. Une faible quantité de lésions à la fin des infections primaires peut engendrer, si l'été est pluvieux, un niveau de tavelure sur fruits inacceptable (1 à 2 %). Puisqu'il est impossible de connaître à l'avance les conditions estivales, un seuil conservateur doit être utilisé pour décider de ne pas traiter contre la tavelure d'été. Une étude récente réalisée au Québec sur McIntosh a démontré qu'un seuil de 0,05 feuilles tavelées par pousse à la fin des infections primaires ne devrait pas être dépassé. À noter que ce seuil n'a été testé qu'au Québec.
| Durée de mouillure (h) | Température (°C) |
|---|---|
| 12 | 9 |
| 11 | 10 |
| 9 | 11 |
| 8 | 12-13 |
| 7 | 14-15 |
| 6 | 16-24 |
| 8 | 25 |
La tavelure d'été : traiter ou ne pas traiter
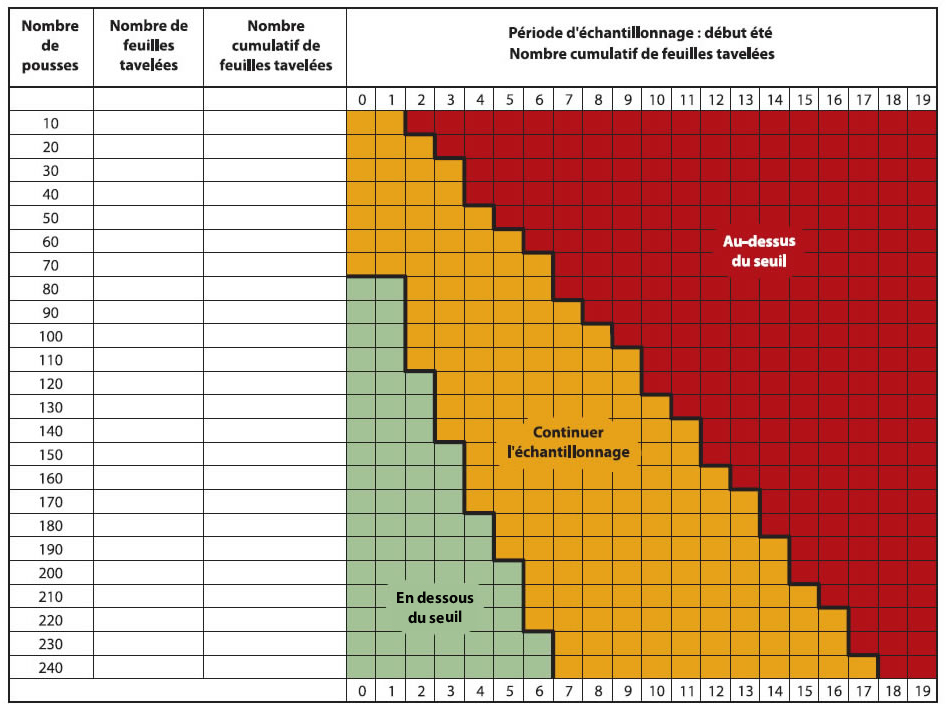
Les producteurs sont avisés d'inspecter leur verger lorsque la période d'infections primaires est terminée et que les lésions sont sorties, soit environ 14 jours après la dernière infection primaire. Il est recommandé d'observer des pousses représentatives du verger; les pousses dans le haut des arbres cachant souvent des lésions. Puisque le seuil proposé est très bas, 0,05 feuilles tavelées par pousse, un plan d'échantillonnage a été développé pour faciliter le dépistage (Figure ci-dessous).
Échantillonnage séquentiel
- Compter le nombre de feuilles tavelées sur un minimum de 80 pousses (bouquets et pousses végétatives) choisies au hasard et réparties dans le verger.
- Si le nombre de feuilles tavelées est sous le seuil (zone verte) une protection serrée ne sera pas nécessaire contre la tavelure d'été.
- Si le nombre de feuilles tavelées est au-dessus du seuil (zone rouge), une protection sans faille sera nécessaire contre la tavelure d'été.
- Si le nombre de feuilles tavelées est dans la zone intermédiaire (zone jaune), continuer l'échantillonnage (une autre série de 10 pousses) avant de prendre une décision.
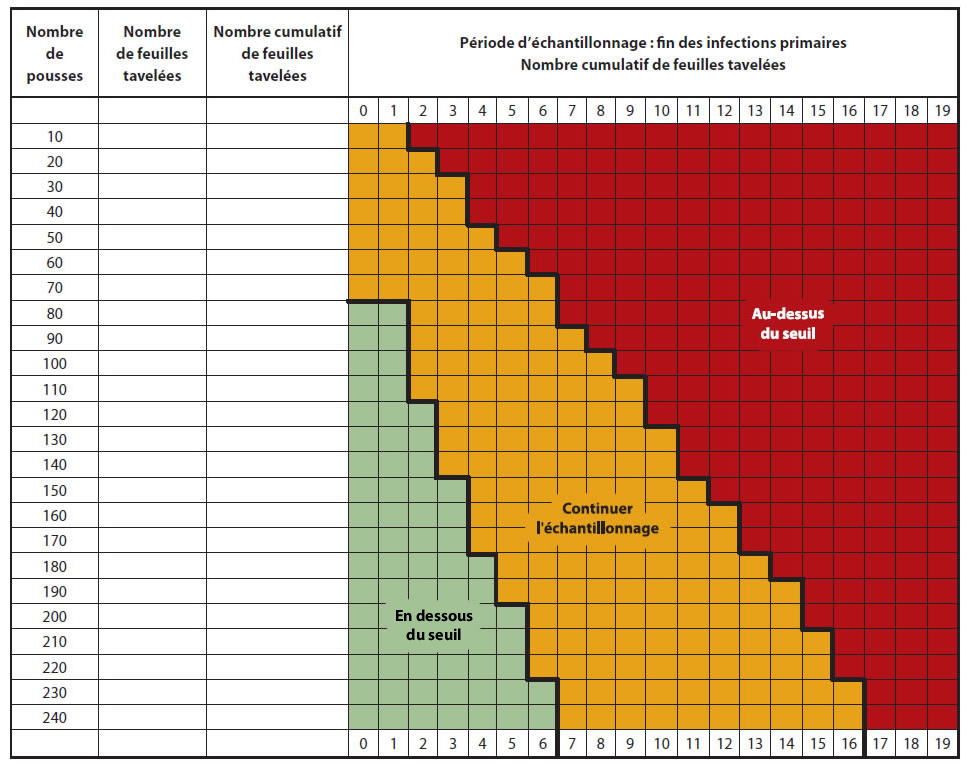
Description de l'image ci-dessus
| Nombre de pousses | Nombre de feuilles tavelées | Nombre cumulatif de feuilles tavelées | Période d'échantillonnage : fin des infections primaires - Nombre cumulatif de feuilles travelées | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |||
| 10 | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 20 | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 30 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 40 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 50 | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 60 | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 70 | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 80 | B | B | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 90 | B | B | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 100 | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | ||
| 110 | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 120 | B | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 130 | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | ||
| 140 | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | ||
| 150 | B | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | ||
| 160 | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | ||
| 170 | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | ||
| 180 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | ||
| 190 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 200 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 210 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | ||
| 220 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | ||
| 230 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
| 240 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
|
||||||||||||||||||||||
Note: If the maximum number of shoots sampled is reached (240 shoots) and a decision cannot be taken (yellow zone). Re-sample one week later.
Description de l'image ci-dessus
| Nombre de pousses | Nombre de feuilles tavelées | Nombre cumulatif de feuilles tavelées | Période d'échantillonnage : fin des infections primaires - Nombre cumulatif de feuilles travelées | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |||
| 10 | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 20 | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 30 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 40 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 50 | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 60 | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 70 | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 80 | B | B | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 90 | B | B | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 100 | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | ||
| 110 | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 120 | B | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 130 | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | ||
| 140 | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | ||
| 150 | B | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | ||
| 160 | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | ||
| 170 | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | ||
| 180 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | ||
| 190 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 200 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 210 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | ||
| 220 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
| 230 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
| 240 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | C | A | A | ||
|
||||||||||||||||||||||
Lutte chimique
Mode d'action des fongicides
Éléments d'une lutte chimique efficace
- L'application des fongicides selon les risques d'infection, le temps écoulé depuis le dernier traitement et les conditions météorologiques;
- Le choix des fongicides, le niveau de risques d'infection et selon une stratégie anti-résistance;
- La bonne dose et la bonne préparation de la bouillie.
Types de fongicides
Il y a globalement 2 types de fongicides homologués au Canada contre la tavelure :
- ceux qui ne sont pas absorbés par les tissus de la plante et qui affectent la germination des spores (protectants).
- ceux qui sont absorbés par la plante et qui affectent la croissance du champignon (curatifs).
Mode d'intervention
Les fongicides peuvent être utilisés selon deux modes d'intervention, soit en préinfection, soit en postinfection.
Un fongicide utilisé en préinfection est appliqué avant le début d'une période d'infection. Le produit sera efficace seulement sur les feuilles et les fruits présents au moment de la pulvérisation en supposant qu'aucun délavage par la pluie n'ait eu lieu. La molécule active agira sur les premiers stades de développement du champignon comme la germination des spores (figure 1). Exemple de fongicides en préinfection : Captan et Dithane.
Les fongicides utilisés en postinfection sont appliqués après une période d'infection. Ces fongicides agissent sur un stade de développement plus avancé du champignon et empêchent celui-ci de coloniser le tissu végétal (figure 2). Cette approche est efficace contre une infection non prévue ou contre les infections graves (risques élevés). Elle permet de pallier à un délavage du traitement précédent. Exemple de fongicides en postinfection : Nova, Flint, Nustar, Scala, Vangard et Sovran.
Figure 1 - Mode d'action des fongicides utilisés en préinfection.
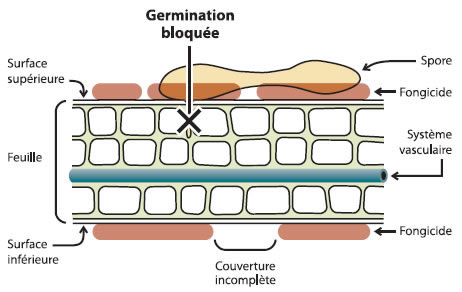
Description de l'image ci-dessus
Une feuille qui a été pulvérisée avec un fongicide de pré-infection a une couverture incomplète sur les surfaces supérieure et inférieure, mais le fongicide aide tout de même à empêcher les spores de germer dans le tissu hôte et dans le système vasculaire de la feuille.
Figure 2 - Mode d'action des fongicides utilisés en postinfection.

Description de l'image ci-dessus
Une feuille qui a été traitée avec un fongicide de post-infection a une couverture complète sur les surfaces supérieure et inférieure ainsi que dans le tissu hôte, mais la croissance du champignon dans la feuille à partir de la spore se produit tout de même.
Modes d'action des fongicides
Les modes d'action des fongicides peuvent être divisés en deux grandes catégories : les fongicides unisites et les fongicides multisites.
Les fongicides unisites agissent à un stade spécifique du développement du champignon. Ces fongicides sont plus sujets au développement de résistance. Une seule mutation ou changement de la part du champignon lui permet d'éviter ou de contrer l'effet du fongicide. La biosynthèse de composés essentiels au développement du champignon, la respiration et les processus de division cellulaire sont les cibles les plus communes des fongicides unisites.
Comme le nom l'indique, les fongicides multisites agissent à plusieurs niveaux du développement du champignon. Ces fongicides sont ainsi beaucoup moins sujets au développement de la résistance. La plupart des fongicides de contact comme Dithane, Captan, Polyram et les éléments comme le soufre et le cuivre appliqués en préinfection font partie de cette catégorie.
Développement de la résistance
Plusieurs facteurs peuvent engendrer un mauvais contrôle de la tavelure : erreur dans l'arrosage, dans la préparation de la bouillie, mauvaise calibration du pulvérisateur, mauvaises conditions d'application, lessivage par la pluie, mauvais moment d'intervention et la résistance du champignon au fongicide. La résistance aux fongicides n'est généralement pas la cause du mauvais contrôle bien que cela puisse être le cas dans certains vergers.
La résistance aux fongicides est un phénomène naturel. Certaines spores ont la capacité d'éviter ou de réduire l'effet de certains fongicides. Ces individus peuvent résister aux fongicides et transmettre leur résistance à leurs descendants. Après plusieurs cycles de reproduction et d'applications de fongicides, la proportion des individus résistants augmente et peut atteindre un niveau qui affecte le contrôle de la tavelure. Le nombre de traitements fongicides nécessaires pour causer une perte de contrôle due à la résistance varie selon le fongicide utilisé, la stratégie d'intervention et la population du Venturia inaequalis présente dans le verger.
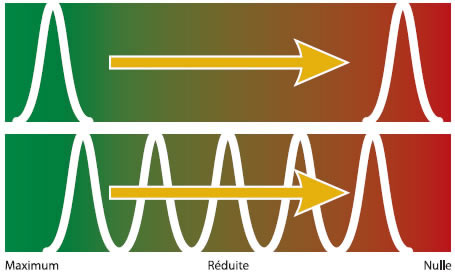
La perte de sensibilité du champignon pour un fongicide peut également se produire selon deux scénarios. Une perte subite de sensibilité qui entraîne une perte rapide et quasi-irréversible d'efficacité. Cette résistance permet au champignon d'éviter complètement l'effet du fongicide, peu importe la dose appliquée. Ce cas s'applique pour les benzimidazoles comme le Benlate et le Senator.
La perte d'efficacité peut être graduelle, comme c'est le cas pour les inhibiteurs d'ergostérol comme Nova et Nustar. Les mécanismes de résistance font en sorte que le champignon peut éviter en partie les effets du fongicide. Le contrôle de la maladie sera alors dépendant de la dose. L'application d'une demi-dose en verger augmentera la pression de sélection sur ces individus moins sensibles.
Efficacité du fongicide
Résistance aux fongicides : état de la situation au Québec
La résistance aux fongicides est un facteur à considérer dans la lutte raisonnée contre la tavelure du pommier. Les mesures anti-résistance sont de mise, peu importe la situation à laquelle votre verger fait face. Une étude réalisée au Québec par Agriculture et Agroalimentaire Canada a récemment permis d'identifier une insensibilité dans un grand nombre de vergers aux inhibiteurs de biosynthèse des stérols (IBS) tels que Nova et Nustar.
Bien que la plupart des producteurs utilisent encore ces produits sans conséquences néfastes majeures, ces résultats méritent une grande attention.
Proportion d'échantillons insensibles au Nova : 70 % Note de bas de page 1 Note de bas de page 3
Les strobilurines, représentées par les fongicides Sovran et Flint, ont aussi fait partie de l'étude réalisée dans les vergers québécois. Bien que certaines souches affichaient une sensibilité réduite à la matière active, il a été démontré que ce mécanisme de résistance n'était pas actif en présence de la plante hôte, réduisant ainsi significativement son impact en verger.
Les cas de résistance aux strobilurines sont nombreux dans les cultures céréalières et sont également rapportés dans certains vergers en Europe. Il faut donc garder l'oeil ouvert.
Le fongicide dodine peut également faire partie d'un programme de gestion de la tavelure. Bien que celui-ci ait été abandonné par bon nombre de producteurs du nord-est des États-Unis en lien avec des cas de résistance, l'étude québécoise démontre qu'il est toujours efficace dans la majorité des vergers échantillonnés. Il faut toutefois demeurer prudent, l'histoire américaine ayant clairement démontré le lien entre l'utilisation de ce produit et le développement et la persistance de la résistance à la dodine. Si le produit a été pulvérisé à maintes reprises au cours des dernières décennies, le verger demeure à risque.
Proportion d'échantillons insensibles à la dodine : 34 % Note de bas de page 2 Note de bas de page 3
Gestion de la résistance aux fongicides
Il est primordial d'inclure dans votre gestion de la tavelure des pratiques visant à contrer ou ralentir le développement de la résistance aux fongicides. Étant donné la faible quantité de fongicides disponibles et efficaces en post-infection, la perte d'un fongicide suite au développement de résistance n'est pas acceptable puisque cela prive les producteurs d'un outil de lutte, diminue le nombre de familles de produits et la possibilité d'alterner parmi ces familles de fongicides.
L'alternance des familles de fongicides d'une pulvérisation à l'autre, particulièrement en post-infection, demeure le moyen le plus efficace de gérer le développement de la résistance. Il est donc recommandé d'éviter les pulvérisations consécutives de produits de la même famille chimique.
L'application de ces fongicides à pleine dose est également très importante. L'exposition du champignon à une demi-dose favorise la sélection d'individus moins sensibles et augmente ainsi leur proportion au sein de la population.
Ne pas oublier que les fongicides unisites sont plus sujets au développement de la résistance et que les fongicides multisites comme le Captan, le Dithane et le Polyram sont moins sujets au développement de la résistance
Soyez à l'affût des diminutions d'efficacité de vos produits. Demeurez conscients que la résistance n'est pas la seule responsable de l'échec d'un traitement fongicide et que plusieurs autres facteurs entrent en jeu dans la gestion de la tavelure.
Les mesures de prévention comme les traitements d'automne incluant l'application d'agents de lutte biologique permettent de réduire l'inoculum primaire (ascospores), aident à ralentir le développement de la résistance aux fongicides et dans certains cas de réduire la quantité de fongicides utilisée.
Les benzimidazoles, incluant le Senator, forment également une famille de fongicides, mais leur efficacité est largement compromise par la présence de résistance.
Familles de fongicides à risque pour la résistance
- IBS
Nova, Nustar - Strobilurines
Sovran, Flint - Anilinopyrimidines
Vangard, Scala - Guanidine
Dodine
Plan d'échantillonnage séquentiel : modèle de feuille de prise de données
Fin des infecttions primaires
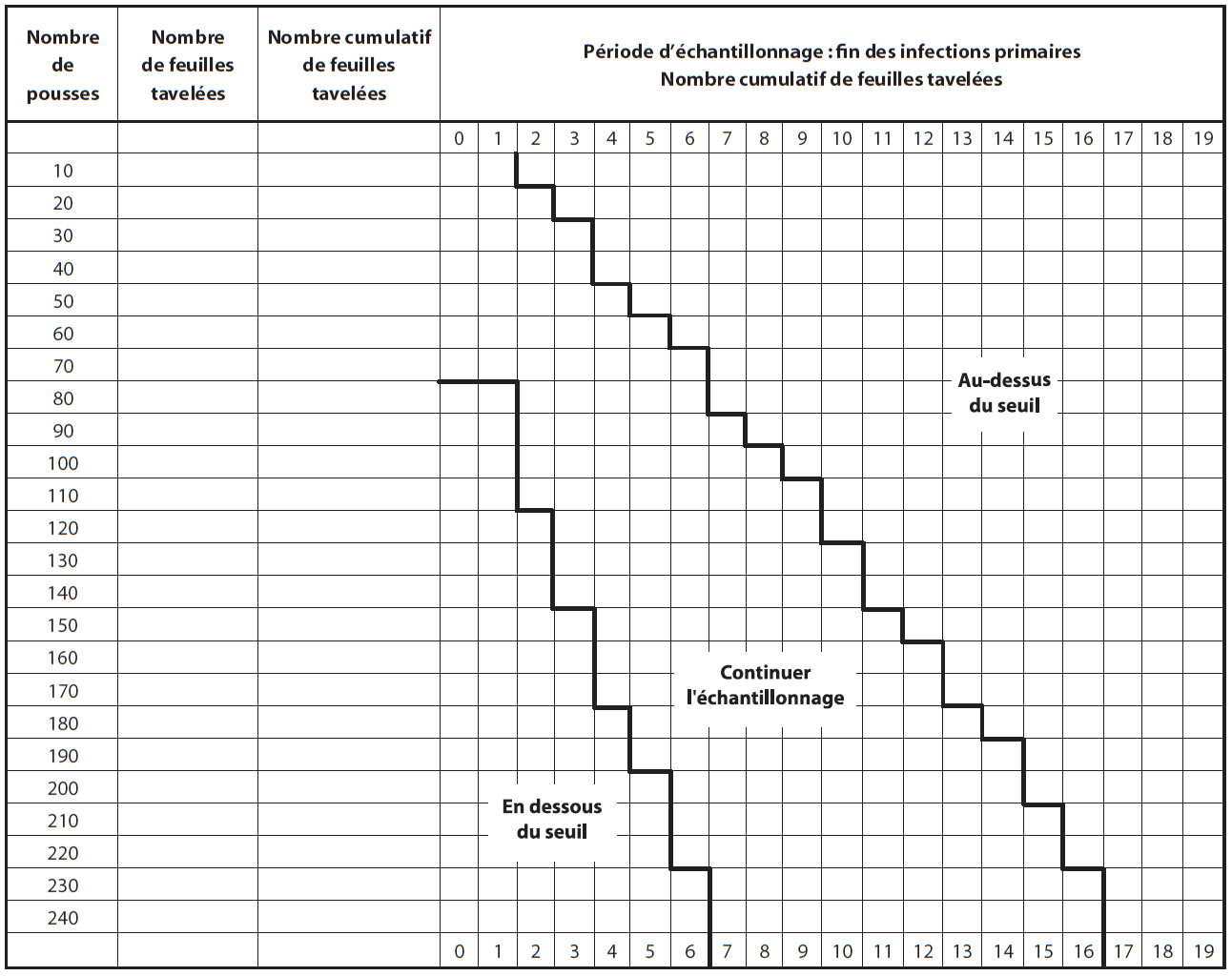
Description de l'image ci-dessus
| Nombre de pousses | Nombre de feuilles tavelées | Nombre cumulatif de feuilles tavelées | Période d'échantillonnage : fin des infections primaires - Nombre cumulatif de feuilles travelées | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |||
| 10 | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 20 | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 30 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 40 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 50 | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 60 | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 70 | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 80 | B | B | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 90 | B | B | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 100 | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | ||
| 110 | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 120 | B | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 130 | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | ||
| 140 | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | ||
| 150 | B | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | ||
| 160 | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | ||
| 170 | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | ||
| 180 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | ||
| 190 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 200 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 210 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | ||
| 220 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | ||
| 230 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
| 240 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
|
||||||||||||||||||||||
Début été
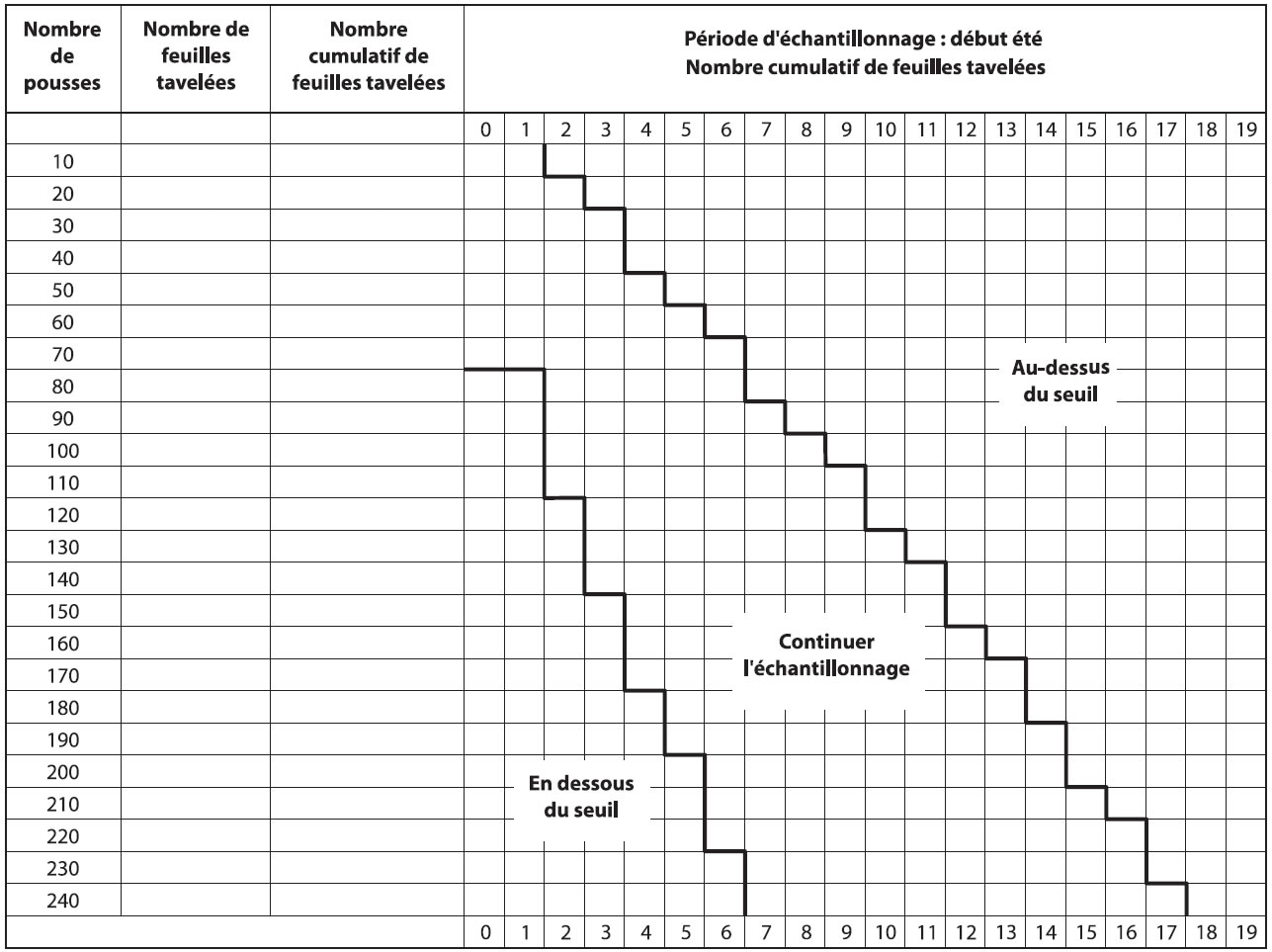
Description de l'image ci-dessus
| Nombre de pousses | Nombre de feuilles tavelées | Nombre cumulatif de feuilles tavelées | Période d'échantillonnage : fin des infections primaires - Nombre cumulatif de feuilles travelées | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |||
| 10 | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 20 | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 30 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 40 | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 50 | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 60 | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 70 | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 80 | B | B | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 90 | B | B | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | A | ||
| 100 | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | A | ||
| 110 | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 120 | B | B | B | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | A | ||
| 130 | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | A | ||
| 140 | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | ||
| 150 | B | B | B | B | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | A | ||
| 160 | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | A | ||
| 170 | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | ||
| 180 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | A | ||
| 190 | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 200 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | A | A | A | A | A | ||
| 210 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | A | ||
| 220 | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
| 230 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | A | A | A | ||
| 240 | B | B | B | B | B | B | B | C | C | C | C | C | C | C | C | C | C | C | A | A | ||
|
||||||||||||||||||||||
Remerciements
Réviseurs
- Dr R. Beresford, chercheur, BioProtection Group. HortResearch, Private Bag 92 169, Auckland, Nouvelle-Zélande
- Dr W.E. MacHardy, professeur de phytopathologie (retraité), Département de Biologie, 246 Spaulding Hall, Université du New Hampshire, Durham NH,U.S.A.
- Dr L. Parisi, chercheur, UERI, Domaine de Gotheron, INRA d'Avignon, 26320 Saint-Marcel-lès-Valence, France.
- Dr L. Berkett, Ph.D., Department of Plant and Soil Science, Hills Building, 105 Carrigan Drive, University of Vermont, Burlington, VT 05405
- Sylvie Bienvenue, technologiste agricole, Centre Agricole Bienvenue Inc.
- Thérèse Otis, agr., gestionnaire des Services de création et de publications scientifiques, Agriculture et Agroalimentaire Canada, Saint-Jean-sur-Richelieu.
Collaborateurs
- Fédération des producteurs de pommes du Québec
- Ontario Apple Growers
Conception
Nora-Audrey Carisse-Landry
Financement
Centre de la lutte antiparasitaire, Agriculture et Agroalimentaire Canada
Conception graphique et mise en page
- Natacha Sangalli, graphiste, Services de création et de publications scientifiques, Agriculture et Agroalimentaire Canada (Saint-Jean-sur-Richelieu).
- Mike Shillinglaw, graphiste, Services de création et de publications scientifiques, Agriculture et Agroalimentaire Canada (Winnipeg).