Protocoles pour la culture in-vivo et in-vitro des CMA (Version PDF, 1,29 Mo)
Ce document présent les Protocoles de laboratoire pour la réalisation de cultures in-vivo et in-vitro de champignons mycorhiziens arbusculaires (CMA). Il est destiné aux étudiants et techniciens de laboratoire désirant cultiver les CMA en condition in vivo ou in vitro.
Graphiques ©BioRender - biorender.com
Protocole 1: démarrer une culture in vivo à partir de spores provenant de culture in vitro

Étape 1. Préparation des pots
Humidifier le sol et autoclaver à deux reprises pendant 60 minutes. Tremper les pots dans une solution savonnneuse, puis dans une solution d'eau de Javel pendant 1 heure, rincer abondamment

Étape 2. Inoculation
Arroser le sol. Déposer les rondelles de gélose contenant les spores dans le sol, 2-3 cm sous la surface, pour éviter le dessèchement.
Planter l'hôte. Utiliser une plantule semée dans un sol stérile.
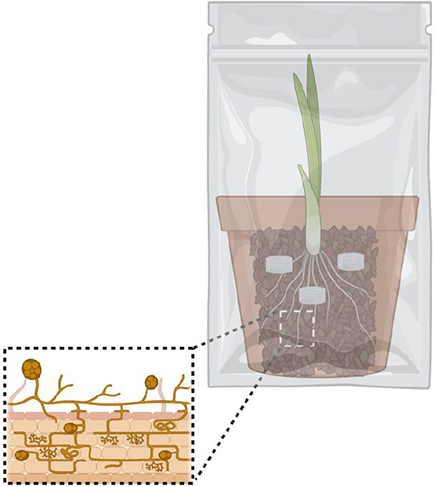
Étape 3. Cultivation
Déposer le pot dans un sac scellé (type Sunbag avec une membrane pour les échanges gazeux) pour éliminer les risques de contamination aérienne.
Arroser et fertiliser au besoin en utilisant un fertilisant à faible teneur en P. Dépendamment de la croissance de la plante, les spores devraient être prêtes pour extraction en 6-8 mois.
Protocole 2: extraire des spores d'une culture in vivo
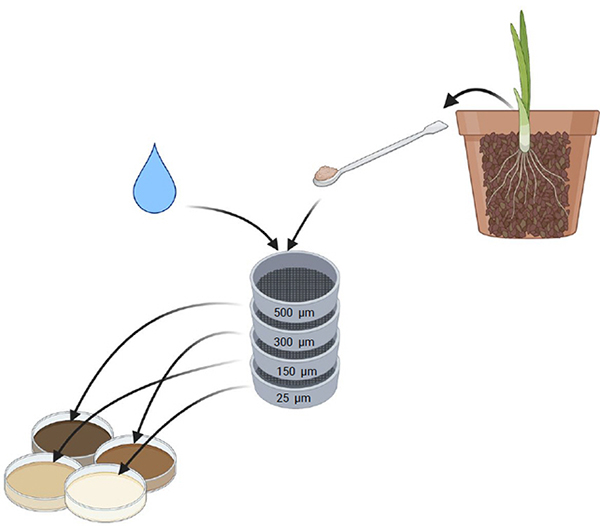
Étape 1. Prélèvement du sol
Prélever un échantillon de sol d'une culture établie depuis au moins 6-8 mois.
Étape 2. Tamisage humide
Procéder au tamisage humide du sol à travers les 4 tamis.
Étape 3. Transférer
Avec de l''eau, transférer chaque fraction de sol dans un plat transparent.
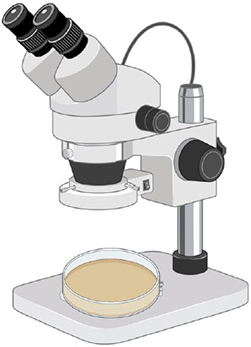
Étape 4. Observation
Observer chaque plat au stéréomicroscope. Utiliser des pinces et une pipette pour extraire les spores.
Protocole 3 : Monter les spores sur une lame de microscope
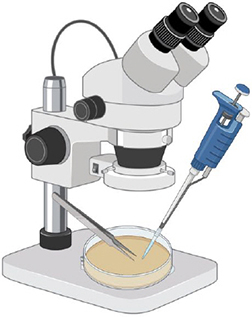
Étape 1.
Extraire les spores d'une fraction de sol.
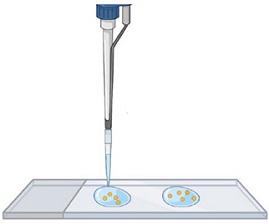
Étape 2.
Transférer les spores sur une lame de microscope : 2 gouttes d'eau avec les spores.
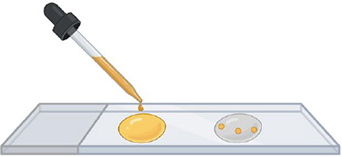
PVLG + Melzer PVLG
Étape 3. Ajouter le milieu de montage
Une fois l'eau évaporé, ajouter une goutte de milieu sur les spores : PVLG d'un côté et PVLG + Melzer de l'autre.
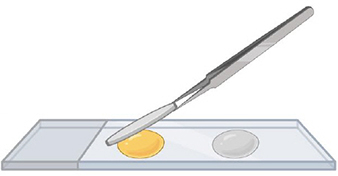
Étape 4.
Ajouter les lamelles et tapoter la surface des lamelles pour écraser les spores. Laisser sécher la lame pendant 24 heures avant de l'observer.
Protocole 4: culture de racines transformées
Toutes les manipulations sont effectuées avec des outils stériles dans une hotte à flux laminaire.
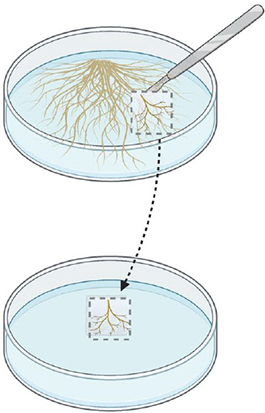
Étape 1.
Couper un morceau de gélose provenant d'une culture établie depuis ~1 mois. Choisir des racines pâles et ramifiées.
Étape 2.
Transférer le morceau de gélose sur dans une nouvelle boîte de Petri contenant du milieu MSR.

Étape 3.
Incuber les boîtes de Petri à 26° C à l'obscurité.
Selon le géotropisme de la racine, les boîtes de Petri devront être incubées à l'envers. Les racines doivent être repiquées mensuellement.
Protocole 5: Établir une culture in-vitro à partir de spores stériles
Toutes les manipulations sont effectuées avec des outils stériles dans une hotte à flux laminaire.

Étape 1.
Déposer les rondelles de gélose contenant les spores sur le milieu de culture. Jusqu'à 4 boîtes de Petri peuvent être préparées avec le contenu d'un tube
Étape 2.
Couper les rondelles de gélose en petits morceaux.
Étape 3.
Couper un morceau de gélose d'une culture de racines transformées établie depuis ~1 mois. Selectionner des racines pâles et ramifiées.
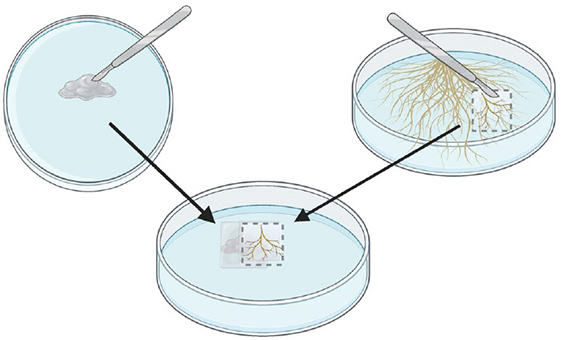
Étape 4.
Déposer le carré de gélose avec racines par dessus les rondelles de gélose écrasées. Presser doucement les racines pour coller les morceaux de gélose ensembles.

Étape 5.
Incuber les boîtes de Petri à 26° C à l'obscurité.
Protocole 6: Établir une culture in-vitro à partir d'une autre culture
Toutes les manipulations sont effectuées avec des outils stériles dans une hotte à flux laminaire.
Étape 1.
Couper un morceau de gélose d'une culture de racines transformées (Ri T-DNA) établie depuis ~1 mois. Choisir des racines pâles et ramifiées.
Étape 2.
Couper un morceau de gélose d'une culture de racines inoculée qui contient de nombreuses spores saines (avec lipides).
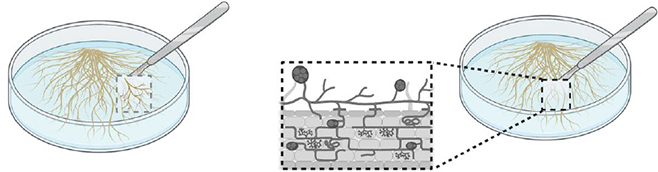
Étape 3.
Transférer le carré de racines et de spores dans une boîte de Petri mono- ou bi-compartimentée.
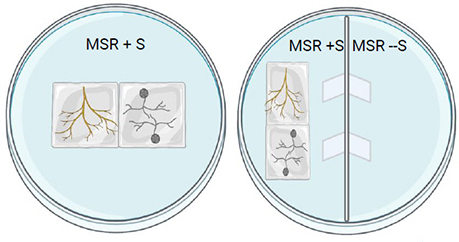
Pour une boîte de Petri bi-compartimenté, placer les spores et les racines dans le compartiment MSR + sucrose. Les hyphes vont traverser les ponts de papier et la sporulation aura lieu dans le milieu sans sucrose.
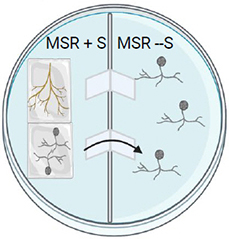
Étape 4.
Incuber les boîtes de Petri à 26° C à l'obscurité.
Protocole 7: stériliser des spores
Toutes les manipulations sont effectuées avec des outils stériles dans une hotte à flux laminaire.
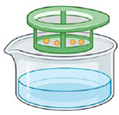
Étape 1.
Sous une hotte à flux laminaire et à l'aide d'une pipette, transférer les spores dans un tamis de 40 μm déposé dans un plat en verre.
Étape 2.
Immerger le tamis dans de l'eau distillée stérile. Agiter doucement pendant 5 minutes en changeant l'eau deux fois. Jeter le liquide.
Step 3.
Immerger dans une solution de Chloramine T 2% avec 1-2 gouttes de Tween. Agiter doucement pendant 3 minutes. Jeter le liquide.

Répéter les étapes 2 et 3 une fois
Étape 4.
Immerger dans de l'eau distillée stérile. Agiter doucement pendant 5 minutes en changeant l'eau deux fois. Jeter le liquide.
Étape 5.
Immerger dans une solution d'antibiotiques streptomycine et gentamicine (0.2 ml / 10 ml solution mère*) Agiter doucement pendant 2 minutes.
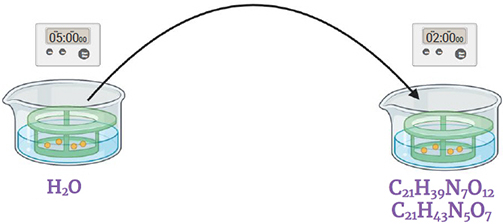
* Streptomycine solution mère: 0.2 g / 20 ml
Gentamicine solution mère: 0.1 g / 20 ml
Références :
Bécard G and Fortin JA (1988). Early events of vesicular–arbuscular mycorrhiza formation on Ri T‐DNA transformed roots. New Phytologist 108, 211–218.
Declerck S, Strullu D-G and Fortin JA. (2005). In Vitro Culture of Mycorrhizas. Springer, Berlin Heidelberg New York, 388 p.
Étape 6.
Transférer les spores avec une goutelette d'antibiotiques une par une dans une boîte de Petri avec milieu HGG (pH 7). Lorsque les goutelettes se sont évaporées, fermer les boîtes et incuber à la noirceur à 26° C avec 2.5% de CO 2 . Vérifier les boîtes chaque jour et s'il y a des contaminants, les enlever rapidement.
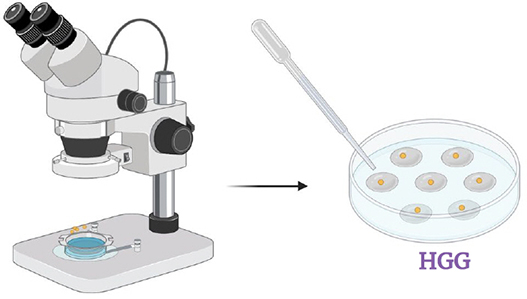
Étape 7.
Dès qu'une spore germe, la transférer sur milieu MSR et placer des morceaux de racines autour de la spore. Incuber la boîte de Petri à 26° C à l'obscurité.

Le morceau de gélose avec la spore doit être placé à l'envers sur la gélose en prenant soin de ne pas endommager la spore ou les hyphes de germination
Protocole 8: Stériliser des racines contenant des vésicules
Toutes les manipulations sont effectuées avec des outils stériles dans une hotte à flux laminaire.
Étape 1.
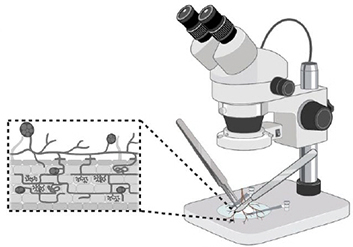
Choisir des racines saines avec des vésicules visibles. Nettoyer les racines, enlever les débris et parties de racines endommagées.
Idéalement, stériliser les racines immédiatement. Sinon elles peuvent être réfrigérées au plus 24 heures.

Étape 2.
À partir d'ici, toutes les manipulations sont effectuées avec des outils stérilisés sous une hotte à flux laminaire.
Placer les racines dans un filet de nylon (100 μm). Plier les rebords pour créer une enveloppe avec les racines à l'intérieur.
Étape 3.
Déposer le filet de nylon plié à l'intérieur d'une cassette d'histologie.
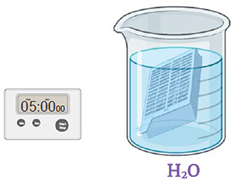
Étape 4.
Immerger la cassette dans de l'eau distillée stérile. Agiter doucement pendant 5 minutes en changeant l'eau deux fois. Jeter le liquide
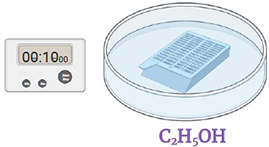
Étape 5.
Immerger dans de l'Éthanol 95% pour 10 secondes. Jeter le liquide.
Étape 6.
Répéter l'étape 4 (rinçage à l'eau distillée)
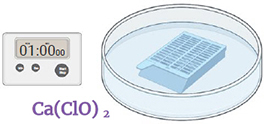
Étape 7.
Immerger dans une solution fraîche d'hypochlorite de calcium 6%, préalablement filtrée. Agiter doucement pendant 1 minute. Jeter le liquide.
Étape 8.
Répéter l'étape 4 (rinçage à l'eau distillée)

Étape 9.
Immerger dans une solution de Chloramine T 2% avec 1-2 gouttes de Tween. Agiter doucement pendant 5 minutes. Jeter le liquide.
Étape 10.
Répéter l'étape 4 (eau distillée)
Étape 11.
Répéter les étapes 9 et 10 (Chloramine T + eau distillée)
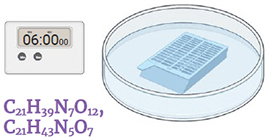
Étape 12.
Immerger dans une solution d'antibiotiques streptomycine et gentamicine (0.2 ml / 10 ml solution mère*
Agiter doucement pendant 6 minutes.
* Streptomycine solution mère: 0.2 g / 20 ml
Gentamicine solution mère: 0.1 g / 20 ml
Étape 13.
Déposer la cassette dans une boîte de Petri contenant une solution d'antibiotiques fraîche.
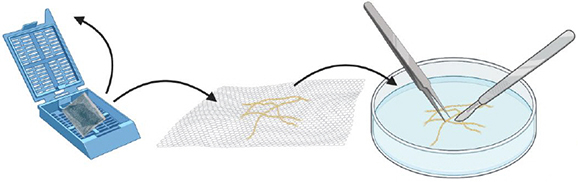
Étape 14.
Ouvrir la cassette, sortir les racines. Couper les racines en morceaux les plus petits possibles avec un scalpel et une pince (approximativement≈ 1-2 mm).
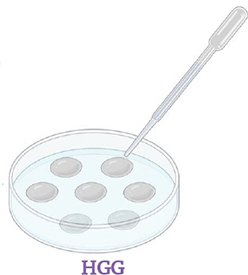
Étape 15.
Transférer les racines une à une avec une goutte d'antibiotiques sur milieu HGG (pH 7). Lorsque les goutelettes se sont évaporées, fermer les boîtes de Petri et incuber à 26° C avec 2.5% de CO 2 à l'obscurité.
Étape 16.
Dès qu'une vésicule germe, la transférer sur milieu MSR et placer des morceaux de culture de racines monoxéniques autour de la racine stérilisée.
Incuber à 26° C à l'obscurité.
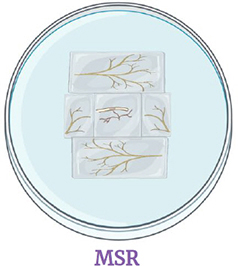
Le morceau de gélose contenant la racine avec la vésicule qui germe doit être placé à l'envers sur la gélose en prenant soin de ne pas endommager les vésicules ou les hyphes de germination.